La incorporación de nuevos tratamientos, procedimientos y tecnologías a la cartera de servicios de los Sistemas de Salud, han de cumplir un triple objetivo: mejorar el acceso de los pacientes a soluciones innovadoras, favorecer la sostenibilidad del sistema y compensar la innovación a los productores de las mismas. (Espín Oliva, y Rodríguez Barrios)
La evaluación económica de la incorporación de nuevos fármacos y tecnologías sanitarias se ha incorporado en los últimos años tanto a la legislación de nuestro país, como a las publicaciones científicas (Rodríguez Barrios et al 2012) para demostrar el valor de dichos nuevos fármacos frente a las alternativas que se proponen sustituir en la práctica clínica.
La incorporación del criterio de eficiencia a los nuevos tratamientos por parte de las agencias reguladoras de las políticas de financiación de los distintos países, a través de evaluaciones económicas es lo que se ha venido a denominar la cuarta barrera o cuarta garantía, (es decir la exigencia a los nuevos tratamientos de ser alternativas coste-efectivas frente a las ya existentes además de exigirles criterios de seguridad, eficacia y efectividad).
La evaluación económica en sanidad tiene como fin la comparación de diferentes tratamientos o programas alternativos de salud en términos, tanto de beneficios clínicos, como de costes imputables a las opciones a comparar (Drumond 2005).
La evaluación económica de tecnologías sanitarias es una herramienta válida en la evaluación de la asignación de recursos sanitarios. No es la única, sin duda, ni tampoco es perfecta, pero en muchas situaciones se puede considerar lo bastante buena como para guiar una correcta toma de decisiones. No es, además, un instrumento aislado o excluyente de otros, sino que junto con la investigación clínica y epidemiológica, el análisis del impacto presupuestario de la introducción de las tecnologías y los estudios de carga y coste de la enfermedad, suponen un marco para facilitar el análisis del impacto de las tecnologías sanitarias en los servicios sanitarios donde se aplican en la práctica real y su papel en la mejora de la salud de la población, fin último de los sistemas sanitarios.
Sin embargo, más allá de las herramientas comúnmente utilizadas para realizar evaluaciones económicas en sanidad (fundamentalmente los análisis coste-efectividad y coste-utilidad), diversos países han incorporado los análisis de impacto presupuestario (AIP) como herramienta para contestar a la preguntas de si los sistemas de salud pueden permitirse pagar los nuevos avances terapéuticos.
El análisis de impacto presupuestario es una estimación cuantitativa de la alteración prevista en el gasto sanitario asociado a la atención de una patología o grupo de pacientes concretos con la introducción de una nueva intervención sanitaria para dicha patología o grupo de pacientes.
Con estos AIP es posible estimar la repercusión económica derivada de la inclusión de un nuevo fármaco dentro de los presupuestos sanitarios, teniendo en cuenta, tanto los costes farmacológicos adicionales derivados del nuevo tratamiento, como el resto de costes sanitarios relacionados con la introducción del nuevo medicamento. Es decir, el AIP es una parte o herramienta más y no está aislada de la evaluación económica de nuevas tecnologías sanitarias que, junto con el análisis coste-efectividad, es utilizado de cara a evaluar la financiación y reembolso de nuevas tecnologías o tratamientos, o de cara a su inclusión en un formulario terapéutico.
Para poder estimar el impacto presupuestario de la introducción de un fármaco es necesario contemplar dos escenarios: el escenario actual o de uso de recursos sanitarios previo a la introducción de dicho fármaco y el nuevo escenario que se produce con la introducción del fármaco. Dicho de otra forma, la introducción del fármaco va a originar una modificación en el uso de diferentes recursos: fármacos alternativos u otros destinados a revertir efectos adversos, tiempo de personal sanitario, visitas ambulatorias u hospitalarias, pruebas diagnósticas, etc. Así, mediante el AIP mediremos la diferencia en costes de ambos escenarios y como resultado obtendremos el impacto en costes de la introducción del nuevo tratamiento.
En el siguiente gráfico, recogido en el artículo de Brosa y colaboradores, (Brosa M, et al), vemos de forma resumida como el análisis de impacto presupuestario, no es más que una diferencia de costes de una enfermedad determinada en un entorno concreto, entre escenarios diferentes de uso de recursos debido a la introducción del nuevo tratamiento en el manejo de dicha enfermedad.
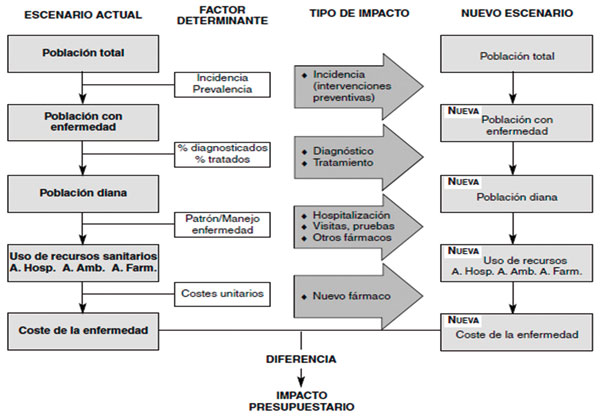
Respecto a la diferencia entre las herramientas comúnmente utilizadas de evaluación económica, como el análisis coste-efectividad o coste-utilidad, y el AIP, podemos resumir que los trabajos de evaluación económica comparan los aumentos o decrementos marginales en términos de beneficios clínicos para los pacientes y costes de un nuevo tratamiento o tecnología. Sin embargo, los AIP calculan el coste diferencial de la introducción de un nuevo tratamiento o programa frente a la situación original de partida en el que este tratamiento no existía. Es decir, ayuda a evaluar el impacto económico de su incorporación y ayuda a la planificación de la incorporación de nuevos tratamientos, programas o políticas de salud, ayudando a prever la financiación necesaria para la incorporación de los tratamientos evaluados.
Este tipo de análisis es de uso común en países como UK (Chambers 2002), Polonia (Orlewska 2004), así como en otros como Canadá (Sulivan S. et al 2014) etc., donde existen guías metodológicas para la realización de dichos análisis. La introducción de un nuevo fármaco va a suponer un cambio en el porcentaje de pacientes tratados. Pero la inclusión del AIP en la toma de decisiones es un elemento que se ha venido proponiendo en los últimos 15 años de forma permanente por investigadores tanto a nivel internacional (Trueman P. 2001), como en nuestro País (Brosa M. et al 2005).
Decíamos anteriormente que en nuestro marco legal se ha venido incorporando en los últimos años el uso por parte de la administración sanitaria del análisis del impacto presupuestario como parte de la evaluación de la financiación de nuevos medicamentos dentro de las prestaciones del Sistema Nacional de Salud. Así, el Real Decreto 9/2011 plantea diferentes criterios a tener en cuenta de cara a la financiación de nuevos tratamientos estableciendo los siguientes criterios:
a) Gravedad, duración y secuelas de las distintas patologías para las que resulten indicados.
b) Necesidades específicas de ciertos colectivos.
c) Valor terapéutico y social del medicamento y beneficio clínico incremental del mismo teniendo en cuenta su relación coste-efectividad.
d) Racionalización del gasto público destinado a prestación farmacéutica e impacto presupuestario en el Sistema Nacional de Salud.
e) Existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a menor precio o inferior coste de tratamiento.
f) Grado de innovación del medicamento.
Es decir, supone la incorporación de forma explícita del uso del AIP junto con el resto de criterios anteriormente detallados, como elementos necesarios en el análisis de la financiación de nuevos tratamientos en nuestro Sistema Sanitario.
Posteriormente, también el Real Decreto Ley 16/2012 reitera la utilización del análisis coste efectividad y el impacto presupuestario en las decisiones de precios y financiación de medicamentos y productos sanitarios. De esta forma, en él se plantea que para la decisión de financiación de nuevos medicamentos, además del correspondiente análisis coste-efectividad y de impacto presupuestario, se tendrá en cuenta el componente de innovación, para avances terapéuticos indiscutibles por modificar el curso de la enfermedad o mejorar el curso de la misma, el pronóstico y el resultado terapéutico de la intervención y su contribución a la sostenibilidad del SNS si, para un mismo resultado en salud, contribuye positivamente al Producto Interior Bruto.
Además en este RD se establece que la Comisión Interministerial de Precios de los Medicamentos tendrá en consideración los análisis coste-efectividad y de impacto presupuestario.
Pero, además del requerimiento legislativo del uso del AIP, su aplicación ha de suponer un consenso entre los distintos agentes implicados. Así, la “Propuesta de guía para la evaluación económica de nuevas tecnologías sanitarias”, publicada en el año 2010, por un grupo de expertos (López- Bastida J et al 2010) que diseñó unos principios guía para la elaboración de evaluaciones económicas en nuestro Sistema de Salud, incluyo también la necesidad de realizar AIP como complemento a la evaluación económica para ayudar a la toma de decisiones sobre incorporación de nuevos tratamientos, y supone un punto de inflexión que es necesario seguir desarrollando en nuestro país.
La citada propuesta de guía fue consensuada por dichos expertos con la colaboración y revisión de las agencias de evaluación de tecnologías sanitarias de nuestro país y tras la recepción de comentarios y propuestas de diferentes expertos de la administración sanitaria, sociedades profesionales, industria farmacéutica, etc.
En dicha guía, respecto al AIP se establece que, aunque no forman parte de los análisis de evaluación económica en sentido estricto, cuando se solicite por parte de las autoridades, se acompañará la evaluación económica de un estudio de impacto en el presupuesto del financiador o financiadores de la introducción de la nueva tecnología en los años siguientes a su adopción.
El horizonte temporal a considerar que se recomienda que pudiera ser de 1, 3 y 5 años. Si bien no existe un estándar, lo ideal sería que el horizonte se consensuara entre el financiador y los autores del estudio.
También Sociedades Científicas como la Sociedad Española de Farmacia Hospitalaria (SEFH) incluyen el análisis de impacto presupuestario, en el ámbito hospitalario, como herramienta del proceso de evaluación de la inclusión de un nuevo fármaco dentro de los formularios hospitalarios.
Por otro lado, en un sistema sanitario donde la prestación de servicios es descentralizada a través de los servicios sanitarios de las diferentes Comunidades Autónomas, se vienen realizando en algunas de ellas, como el caso del Servicio de Prestaciones Farmacéuticas del Servicio Vasco de Salud, análisis de impacto presupuestario para informar a las autoridades de dicha comunidad autónoma sobre el impacto financiero de la introducción de medicamentos denominados de alto impacto. Así mismo en Cataluña, el CatSalud ha publicado recientemente unas guías metodológicas para la presentación de estudios coste-efectividad e impacto presupuestario para aquellos fármacos que pretendan ser financiados como parte de la prestación farmacéutica en dicha CCAA (Puig-Junoy J. .2014).
La aplicación de forma práctica de los criterios implicados en el desarrollo legislativo anteriormente citado y en las guías expuestas, ha de hacerse siguiendo consensos y pautas metodológicas publicadas y reconocidas que aseguren la calidad e independencia de los análisis. Las diferentes guías comentadas, establecen una serie de elementos comunes a tener en cuenta en la elaboración de los AIP como son:
-
Especificar las características del Sistema Sanitario donde se incorpora el nuevo tratamiento.
-
Definir la perspectiva del estudio. Por ejemplo, del financiador si el AIP se hace para el dossier de reembolso de la comisión interministerial de precios de medicamentos; del pagador, si se realiza desde el servicio de prestación farmacéutica de una comunidad autónoma; o del Hospital si se hace desde la comisión de Farmacia de un Hospital.
-
Valorar el uso y coste de los recursos implicados en la utilización del nuevo tratamiento, y de los ya existentes a los que éste sustituirá total o parcialmente. Para su cálculo adecuado, habrá de tenerse en cuenta:
-
La población elegible candidata a recibir dicho tratamiento.
-
Los tratamientos o intervenciones terapéuticas que actualmente se realizan antes de la introducción del medicamento, (identificarlas y cuantificarlas).
-
Grado estimado de sustitución del nuevo tratamiento, en los años incluidos en el horizonte temporal de la evaluación, respecto a los tratamientos existentes.
-
Análisis de todos los costes clínicamente relevantes y que puedan tener un impacto en los recursos utilizados en el manejo de la patología. Dichos costes, dependerán de la perspectiva del estudio, (financiador, asegurador, etc.), aunque las guías nacionales e internacionales, recomiendan tender a incluir la perspectiva social en el análisis. Dichos costes se analizarán para cada alternativa a evaluar y se incorporará también los costes debidos del impacto del nuevo tratamiento en otros recursos sanitarios (diferentes efectos adversos, utilización de recursos hospitalarios, pruebas diagnósticas, días de enfermedad, consultas, hospitalizaciones, etc…). Es decir, se tendrán en cuenta tanto los costes relacionados con la enfermedad, como los costes indirectos.
-
Se definirá adecuadamente el horizonte temporal del estudio. Normalmente en las guías internacionales se recomienda entre 3 y 5 años con información también del primer año.
-
Descripción clara y referenciada de las fuentes de las asunciones tomadas en el estudio.
-
Justificación del modelo analítico empleado en la realización de los cálculos.
-
Análisis de las incertidumbres relacionadas con la estructura del modelo, los datos, fuentes de información del mismo etc., mediante técnicas adecuadas.
-
Validación metodológica del modelo siguiendo las recomendaciones metodológicas adecuadas.
Independientemente de la instancia administrativa en la que se desarrollen este tipo de estudios, si finalmente su aplicación en la toma de decisiones sobre incorporación de nuevos tratamientos, va a establecerse de forma habitual, se deberán de cumplir una serie de requisitos que facilite su implementación de forma eficiente, estos podrían ser:
-
Conocimiento por parte de los distintos agentes implicados, (administraciones, industria, profesionales), de los requerimientos metodológicos, plazos y procesos para su preparación, presentación etc.
-
Estructuras de participación claras que faciliten la participación y corresponsabilidad de todos y cada uno de dichos actores implicados, (agencias evaluadoras a nivel nacional y regional, sociedades científicas, industria, pacientes, etc.)
-
Aplicación real de los requerimientos legales y las pautas metodológicas acoradas para la realización y presentación de dichos estudios.
-
Utilización de estas herramientas como soporte a la toma de decisiones informadas en el sector salud, y no como mera herramienta de control de costes o de retardo de la incorporación de innovaciones terapéuticas previamente aprobadas por las agencias reguladoras a nivel europeo y nacional.
-
Asegurar los presupuestos necesarios para adaptar las decisiones informadas a partir de los AIP realizados.
Únicamente desde la aplicación de los criterios anteriormente planteados y de una voluntad política clara de incorporar estas herramientas como instrumentos de reducción de la incertidumbre para los distintos actores implicados en la introducción de nuevas tecnologías, podrá favorecerse el acceso a los nuevos tratamientos, y la superación de las necesidades médicas no cubiertas que los pacientes y los sistemas sanitarios tienen, mediante la incorporación racional de las novedades terapéuticas.
REFERENCIAS:
Espín J, Oliva J, Rodríguez Barrios JM. Esquemas innovadores de mejora de acceso al mercado de nuevas tecnologías: acuerdos de riesgo compartido. Gac. Sanit. 2010; 24: 491-7.
Rodríguez-Barrios José Manuel, Innovaciones en el uso de la economía de la salud en la evaluación de la incorporación de nuevas tecnologías sanitarias en el Sistema Sanitario Español. Tesis doctoral Octubre 2013 Universidad Rey Juan Carlos, Facultad de Ciencias dela Salud
Rodríguez-Barrios José Manuel, Paz Silvia, Lizán Luis, González Paloma., The use of Quality Adjusted Life Years (QALYs) in the economic evaluation of health technologies in Spain: a review of the 1990-2009 literature Value in Health 2011; 14(4); 458-464.
Drummond MF, Sculpher MJ, Torrance GW, O’Brien BJ, Stoddart GL. Methods for the Economic Evaluation of Health Care Programmes. 3rd ed. Oxford University Press; 2005
Boletín Oficial del Estado. Real Decreto Ley 16/2012 de 20 de Abril, de medidas urgentes para asegurar la sostenibilidad del SNS y mejorar la calidad y sostenibilidad de sus prestaciones. BOE núm. 98 de 24 de Abril de 2012. 31278–310.
López-Bastida J, Oliva J, Antoñanzas F, García- Altés A, Gisbert R, Mar J, et al. Propuesta guía para la evaluación económica aplicada a las tecnologías sanitarias. Gac Sanit. 2010;24(2):154–70.
Chambers M, Hutton J,, Nuijten M. “Budget impact analysis for health technology appraisal: development and application within the NICE appraisal process.” Journal of Clinical Excellence (2002) 4:203-206.
Sullivan S, Mauskopf J, Augustovski F, Caro JJ, Lee K, Minchin M, Orlewska E, Penna P, Rodriguez Barrios JM, Shau WY. Budget Impact Analysis - Principles of Good Practice: Report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value in Health 2014; 17(1);5-14
Trueman P, Drummond M, Hutton J. Developing guidance for budget impact analysis. Pharmacoeconomics. 2003; 19: 609-621
Brosa M, Gisbert R, Rodríguez Barrios JM, Soto J Principios, métodos y aplicaciones del Análisis de Impacto Presupuestario en Sanidad.. Pharmacoeconomics Spanish Research Articles June 2005, 2(2); 65-79
Puig-Junoy J, Oliva-Moreno J, Trapero-Bertrán M, Abellán-Perpiñán JM, Brosa-Riestra M y Servei Català de la Salut (CatSalut). Guía y recomendaciones para la realización y presentación de evaluaciones económicas y análisis de impacto presupuestario de medicamentos en el ámbito del CatSalut. Generalitat de Catalunya. Departament de Salut. Servei Català de la Salut: Barcelona, 2014.














