En este artículo se revisan en primer lugar las principales características y limitaciones de los ECA para, a continuación, presentar sucintamente los principales métodos de investigación clínica y epidemiológica con especial atención a su contribución a la evidencia científica y a los sesgos que con más frecuencia comprometen su validez. Finalmente, se enumeran las condiciones que debe cumplir un estudio idóneo y los rasgos distintivos de calidad de una buena CRO.
Es de dominio común que los ensayos clínicos aleatorios (ECA) en sus diversas variantes y los análisis agregados de estos, los meta-análisis, constituyen los métodos de investigación clínico-epidemiológica que proporcionan las evidencias científicas más sólidas cuando se trata de conocer la eficacia de un fármaco en comparación a otro(s) o respecto a placebo1, 2.
Los ECA son estudios que responden a una finalidad experimental que analiza el efecto de una intervención o de un fármaco, y cuyo diseño responde, al menos, a las condiciones metodológicas siguientes:
1.- Debe formularse una o varias hipótesis teóricas con su(s) correspondiente(s) predicciones.
2.- La investigación tiene que ser necesariamente prospectiva.
3.- La intervención o tratamiento ha de estar perfectamente definido.
4.- Es imprescindible la existencia de un grupo control al que se compara el grupo de estudio o intervención.
5.- La asignación a un grupo u otro de tratamiento ha de realizarse de forma aleatoria (randomizada), de forma que cada paciente tenga las mismas probabilidades de ser incluido en uno u otro grupo.
6.- La asignación a los grupos ha de ser tan enmascarada como sea posible; es decir, a doble ciego (ni pacientes ni investigadores conocen la asignación a cada grupo) o, idealmente, a triple ciego (quiénes analizan los datos tampoco conocen la asignación de los pacientes a los grupos).
7.- El conjunto del proceso ha de ser cerrado; esto es, las condiciones iniciales del protocolo del ensayo no pueden cambiarse durante su realización.

Sin embargo, dado que por su diseño no disponen de grupo de control, este rigor metodológico no se aplica a las investigaciones clínicas de farmacocinética y farmacodinamia preliminares (fase I), ni a los estudios de fase II que tienen como objetivo principal proporcionar información preliminar sobre la eficacia del producto y establecer la relación dosis-respuesta del mismo3; aunque también se denominan impropiamente ensayos clínicos.
Pese a ser el gold standard de la investigación clínica, los ECA también tienen, al menos, dos tendones de Aquiles: (a) las pérdidas de seguimiento que, en caso de ser elevadas, además de una pérdida de potencia estadística, pueden implicar un sesgo de selección, en especial, cuando se producen de manera desigual en cada brazo; y (b), el igualmente sesgo de selección que se introduce con frecuencia mediante los criterios de exclusión de los pacientes participantes. En efecto, aunque se trata de un hecho que por exigencias del mercado se tiende a obviar, para asegurar su validez interna los ECAs no suelen incluir a pacientes con determinadas co-morbilidades y/o tratamientos farmacológicos frecuentes en la población real; de modo que la población experimental difiere significativamente de la población a la que finalmente está destinado un fármaco dado (véase figura 2). En estos casos se da la paradoja siguiente: cuanto mayor es la validez interna, menor es la validez externa o poder de generalización. De ahí, el auge experimentado a lo largo de los últimos años por la investigación traslacional que comprende cualquier diseño, de intervención o observacional analítico cuyo propósito sea contrastar conocimiento obtenido en condiciones experimentales a población asistida en práctica clínica habitual, incluyendo los estudios fármaco-económicos; si bien, algunos autores también incluyen dentro de esta denominación a la traslación de toda aplicación de la investigación científica básica sobre nuevos enfoques preventivos, diagnósticos y terapéuticos5, 6.

Asimismo, son diseños de intervención cuasiexperimentales; esto es, parecidos a los ECA, aunque menos restrictivos (véase la figura 1):
* Los ensayos de campo que sirven para evaluar el efecto de factores preventivos (vacunas, dietas, etc.), por lo que se realizan con sujetos que aún no han adquirido la enfermedad y tanto el enmascaramiento como la randomización pueden ser mecánicamente imposibles y/o éticamente impracticables.
* Las intervenciones comunitarias que casi nunca pueden enmascararse y raramente pueden aleatorizarse.
Por otra parte, es importante tener en cuenta que hay cuestiones de sumo interés clínico y epidemiológico que no pueden ser resueltas por medio de ECAs, como son, por ejemplo, la estimación de tasas de incidencia y de prevalencia de enfermedades o de factores de riesgo, la estimación de proporciones de pacientes adherentes a sus tratamientos o de frecuencias relativas de médicos cuyas decisiones clínicas se ajustan a recomendaciones de guías de práctica clínica. Ante estas cuestiones procede realizar estudios observacionales retrospectivos, también denominados de prevalencia o transversales (véase figura 3). Sin embargo, tal como sucede con todos los métodos de investigación, estos diseños también están sujetos a posibles sesgos que comprometen su validez, siendo también los más repetidos los de selección, cuando por obvios motivos logísticos se suele sustituir la población diana por pacientes atendidos en los servicios de salud hospitalarios y/o ambulatorios, en general públicos.
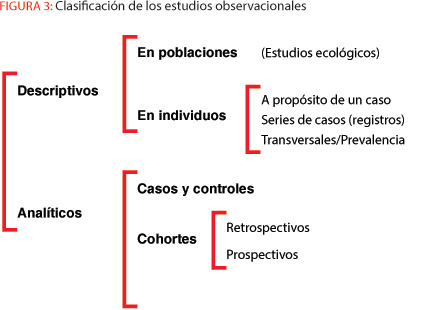
En el peldaño más bajo de las tablas de evidencia figuran los estudios ecológicos, cuya principal peculiaridad es que, en lugar de individuos, la unidad de análisis son grupos de población (familia, escuela, hospital, CCAA, estado, etc.), sean: (a) geográficos, cuando se comparan distintas unidades geográficas; (b) temporales, cuando se comparan los cambios observados en una misma unidad geográfica a lo largo del tiempo; y (c), mixtas, cuando se comparan simultáneamente distintas unidades geográficas y su evolución temporal.
En los estudios ecológicos se observa y, por ello, es posible analizar estadísticamente la asociación entre una exposición y un resultado a nivel de grupo. No obstante, en estricto sentido, no son válidos para contrastar hipótesis de asociación, ya que tanto la llamada falacia ecológica (una asociación observada entre variables agregadas no necesariamente se da a nivel individual) como el sesgo de agregación (se adjudica a todos los individuos las características del grupo al que pertenecen) son implícitos al propio diseño7. Así pues, es más propio considerar a los estudios ecológicos como parte de la epidemiología descriptiva que de la analítica. Se trata, sin embargo, de un tipo de diseño que por su simplicidad y facilidad de realización es muy útil para la formulación de nuevas hipótesis. Además, poseen ciertas ventajas que merecen ser consideradas: (a) son baratos y rápidos de realización, ya que por lo común utilizan datos de rutina; y (b), las técnicas estadísticas para analizar los datos son igualmente sencillas.
En un punto intermedio de la evidencia científica están los diseños observacionales analíticos; y, dentro de estos, dada su relativa facilidad de realización en tiempo y costes, destacan los estudios de casos y controles, también llamados casos y testigos, y casos y no casos. Se trata de un método de investigación ideado en el siglo XIX por John Snow, un médico inglés considerado el padre de la epidemiología moderna, cuando comparó casos y no casos en cuanto a su lugar de residencia y fuente de agua potable mientras investigaba las causas de una epidemia de cólera acaecida en Londres8.
Tal como su misma denominación indica, este diseño se basa en comparar un grupo, en general pacientes, que presenta un efecto, por lo común una enfermedad, respecto a otro grupo de características semejantes, pero que no presenta la enfermedad, con el propósito de identificar qué variables, a menudo factores de riesgo, diferencian a ambos grupos; o dicho de otro modo: este diseño busca comparar la frecuencia de exposición a la(s) variable(s) independientes(s) entre los individuos caso y los sujetos control. Así, el objetivo principal de los estudios de casos y controles es estimar la fuerza de asociación de una posible relación causa-efecto por medio de un estimador del riesgo relativo denominado odds ratio (OR) o razón de chances o de momios9.
La principal limitación de este diseño es que la odds ratio únicamente es un buen estimador del riesgo relativo o hazard ratio cuando se aplica a enfermedades de baja prevalencia (≤5%), en tanto que su punto más débil es su alta vulnerabilidad a diversos tipos de sesgo, siendo la no comparabilidad entre el grupo de casos y el de no casos lo que con más asiduidad compromete su validez interna y, por consiguiente, también la externa. Otra limitación de los estudios de casos y controles es que no permiten sustentar relaciones de naturaleza etiológica.
Pese a que muchos autores entre los que me encuentro consideran que los estudios de cohortes, asimismo llamados de seguimiento (follow-up studies) o longitudinales, tienen más poder que los estudios de casos y controles10, 11, algunas tablas de evidencia científica (véase figura 4) también los sitúan un eslabón justo por debajo de los ECA. En general, los estudios de cohortes se emprenden para apoyar la existencia de una asociación entre una causa sospechada y una enfermedad, si bien en ocasiones son el resultado de estudiar post hoc los datos retrospectivos obtenidos en uno de los brazos de un ECA, normalmente el de intervención. Un ejemplo de ello son los análisis post hoc que con frecuencia se realizan con pacientes oncológicos tratados con fármacos biológicos al objeto de identificar variables que distingan a los pacientes respondedores de los que no lo son.

A diferencia de los ECAs, los estudios de cohortes son estudios observacionales (no introducen ningún tipo de intervención) en los cuales las personas o las poblaciones se seleccionan sobre la base de si han estado expuestos a un riesgo dado, recibieron un procedimiento preventivo o terapéutico específico, o poseen una cierta característica; y, a continuación, se siguen durante un período de tiempo para evaluar el resultado de la exposición, el procedimiento o el efecto de la característica; por ejemplo, la aparición de una enfermedad12.
Según sea su dirección temporal, los estudios de cohorte pueden ser prospectivos, retrospectivos o mixtos. Los datos obtenidos permiten estimar la incidencia de la enfermedad o evento objeto de la investigación, y comparar los subconjuntos de la cohorte que estuvieron expuestos y no expuestos por medio del riesgo relativo y atribuible a un factor dado10. De modo semejante a los ECAs, el sesgo que amenaza con más asiduidad a los estudios de cohortes es el de selección debido a las pérdidas de seguimiento que se correlacionan directamente con el tiempo de observación. Aun siendo un método de investigación muy valioso, este diseño es bastante más costoso que el de casos y controles, y no es adecuado para enfermedades raras, dado que para su observación se requerirían muestras demasiado grandes y/o excesivo tiempo de seguimiento.
Tradicionalmente, a las series de casos, con frecuencia obtenidas mediante registros de las enfermedades, se les ubica con razón en la parte baja de las tablas de evidencia tan solo un peldaño por encima de la opinión experta. No obstante, recientemente, un nuevo concepto denominado big data está llevando a las series de casos a una nueva dimensión que, en mi opinión, más pronto que tarde obligará a reconsiderar su posición en el conjunto de la evidencia científica; puesto que, sin duda, cientos de miles o millones de casos homogéneos con datos de buena calidad poseen un enorme valor potencial como herramienta productora de conocimiento objetivo, tanto más cuanto la emergencia de estos sistemas de información de tamaño enorme está propiciando en paralelo el desarrollo de nuevas y potentes técnicas de análisis estadístico13, 14.
Por su parte, a lo largo de los últimos dos lustros y al rebufo de la actual crisis económica, los estudios farmacoeconómicos han experimentado un notable auge. En concreto, la economía de la salud se desarrolla a partir de cuatro perspectivas analíticas de las intervenciones sanitarias con frecuencia, aunque no necesariamente, de carácter farmacológico: (a) los estudios de minimización de costes que buscan identificar las intervenciones o tratamientos más baratos; (b) el análisis de coste-efectividad (ACE) que mide el beneficio en términos sanitarios de una o varias intervenciones15; (c) el análisis coste-beneficio (ACB) que mide tanto el coste como el beneficio en términos monetarios16; y (d), el análisis coste-utilidad (ACU) que pondera el beneficio de una intervención por la calidad de vida medida en términos de años ganados de vida en buena salud (AVAC)17.
La farmacoeconomía puede valerse de diferentes diseños según sea el propósito de la investigación; si bien es bastante común utilizar diseños naturalísticos (pre y post intervención o pre y post tratamiento).
Aunque no aportan ningún diseño metodológico específico, esta panorámica no estaría completa sin mencionar a una orientación de la investigación clínica sumamente interesante surgida más recientemente y que, probablemente, incrementará su presencia en años venideros. Es la denominada Patient Centered Outcomes Research (PCOR)18 o investigación de resultados centrados en el paciente. Consiste en impulsar y realizar proyectos de investigación que «ayuden a las personas y a sus cuidadores a comunicarse y tomar decisiones médicas informadas, permitiendo que sus voces sean escuchadas en la evaluación del valor de las opciones de atención médica»19. Así, este nuevo enfoque de la investigación clínica y epidemiológica se propone contestar a preguntas que los pacientes se hacen con frecuencia y que, hasta la fecha, las ciencias médicas han prestado escasa atención. De hecho, se trata de evaluar los riesgos y beneficios de las intervenciones preventivas, diagnósticas, terapéuticas y paliativas en términos, no sólo de supervivencia sino también de calidad de vida, autonomía funcional y preferencias de los pacientes con el loable propósito de ayudarles a tomar las decisiones que más les convengan de acuerdo a sus singulares condiciones. Es por ello que las asociaciones de pacientes tienen buenos motivos para impulsar la PCOR; y, por consiguiente, tanto la industria farmacéutica como las administraciones sanitarias también.
En definitiva, la experiencia te enseña que el diseño idóneo es aquel que mejor se ajusta al objetivo principal planteado y es capaz de contrastar las hipótesis en el tiempo y costes previstos. En consecuencia, la fiabilidad de una CRO reside en saber proponer el diseño más eficiente, ser capaz de desarrollarlo en un protocolo preciso y detallado, tener la habilidad de gestionar con agilidad tanto el trabajo de campo como los cada vez más numerosos requisitos burocráticos, analizar los datos con las técnicas estadísticas más apropiadas, interpretar los resultados con pulcritud y sentido, e identificar la revista médica más apropiada para su publicación y ulterior difusión.
Referencias
1. http://svgo.es/sites/default/files/Medicina%20basada%20en%20la%20evidencia.pdf. Consultado el 11 de octubre de 2017.
2. https://www.sefh.es/bibliotecavirtual/libroensayosclinicos/Libro_ECEspana.pdf Consultado el 11 de octubre de 2017.
3. https://www.boe.es/doue/2014/158/L00001-00076.pdf. Consultado el 11 de octubre de 2017.
4. Laporte, J R. Principios básicos de investigación clínica. (Cap. 3). UAB, 1993.
5. McGartland Rubio, D. et al. Defining Translational Research: Implications for Training. Acad Med. 2010 Mar; 85(3): 470–475. doi: 10.1097/ACM.0b013e3181ccd618
6. Woolf, Steven H. The Meaning of Translational Research and Why It Matters. JAMA. 2008;299(2):211-213 (doi:10.1001/jama.2007.26)
7. http://www.gocnetworking.com/ventajas-y-limites-de-los-estudios-ecologicos/. Consultado el 16 de octubre de 2017.
8. Snow J. On the mode of communication of cholera. Churchill 1855. En: Snow on cholera, Commonwealth Fund 1936, reimpresión en Hafner Press, 1965
9. Breslow NE, Day NE. Statistical methods in cancer research. The design and analysis of cohort studies. Vol. II. Lyon, Francia: International Agency for Research on Cancer, 1994.
10. Shadish, W R et al. Experimental and Quasi-Experimental Designs for Generalized Causal Inference (2nd ed.). Boston: Houghton Mifflin Company. p. 267. ISBN 0-395-61556-9.
11. Mutch, L M M et al. Follow up studies: design, organisation, and analysis. Archives of Disease in Childhood, 1989, 64, 1394-1402
12. Porta, M. A Dictionary of Epidemiology. Oxford University Press. Sixth Edition. (2014).
13. Hsinchun Chen et al. Business intelligence and analytics: from big data to big impact. MIS Quarterly Vol. 36 No. 4, pp. 1165-1188/December 2012
14. http://bigdata-madesimple.com/26-popular-techniques-for-analysing-big-data/. Consultado el 15/10/2017.
15. Pinto-Prades, JL et al. El análisis coste-efectividad en sanidad. Atención Primaria. Vol. 27. Núm. 4. 15 de marzo 2001
16. Puig-Junoy, J et al. El análisis coste-beneficio en sanidad. Atención Primaria. Vol. 27. Núm. 6. 15 de abril 2001
17. Pinto-Prades, JL et al. Análisis coste-utilidad. Atención Primaria. Vol. 27. Núm. 8. 15 de mayo 2001.
18. Selby, J V et al. The Patient-Centered Outcomes Research Institute (PCORI) National Priorities for Research and Initial Research Agenda. JAMA, April 18, 2012—Vol 307, No. 15
19. Gabriel, S E et al. Getting the Methods Right — The Foundation of Patient-Centered Outcomes Research. N Engl J Med. 2012 Aug 30;367(9):787-90. doi: 10.1056/NEJMp1207437. Epub 2012 Jul 25.

















