El año 2020 será recordado como el año de la pandemia COVID-19, aunque el coronavirus causante de la enfermedad fuera descubierto en el 2019. Desde que nos dimos cuenta de su gravedad, estamos todos muy pendientes de los resultados de los ensayos clínicos de las diferentes vacunas y de los tratamientos para esta enfermedad. Sin embargo, en los hospitales ya se estaban haciendo otros ensayos clínicos de enfermedades tan conocidas como el cáncer, cuyas actividades diarias se han visto afectadas por la pandemia.

Los hospitales y las CROs (del inglés Contract Research Organizations) encargadas de gestionar los ensayos han tenido que realizar cambios para adaptarse a la realidad presente y así poder seguir realizando investigación clínica sin poner en riesgo a los pacientes y al personal involucrado, e intentar reducir al mínimo el impacto del incumplimiento al protocolo.
Impacto y adaptación en los hospitales
El primer cambio que se intentó incorporar en los hospitales fue el teletrabajo. Sin embargo, esto no fue tan sencillo como en otros centros de trabajo ya que el personal sanitario necesita para trabajar el programa de gestión de historias clínicas. Este programa no se puede instalar en los ordenadores personales y además uno tiene que estar en la red del hospital para poder usarlo. En muchos hospitales se han tenido que acelerar la implantación del acceso remoto al escritorio (VPN) o una versión web del programa de historias clínicas con acceso limitado a la información, para poder trabajar desde casa con un ordenador personal. Gracias a esto, se han podido hacer turnos de trabajo entre los datas entries y entre los coordinadores para que hubiera el mínimo número de personas en el centro y por tanto, compartiendo un mismo espacio físico. De esta manera se pudo seguir atendiendo a los pacientes que venían a tratarse dentro de un ensayo y se evitó un retraso masivo en el reporte de los datos.
El acceso remoto también ha permitido que los médicos pudieran hacer consultas por teléfono desde su casa. Esto ha sido especialmente importante ya que prácticamente todos han tenido que asistir a pacientes ingresados con COVID-19 y, por tanto, al haber más riesgo de contagio, tenían más probabilidades de tener que hacer cuarentena en casa.
La EMA (del inglés European Medicines Agency) y AEMPS (Agencia Española de Medicamentos y Productos Sanitarios) dieron algunas recomendaciones (1), que dependiendo de cada hospital se siguieron algunas o casi todas. Entre ellas, recomendaban realizar las analíticas en los ambulatorios, enviar la medicación oral a casa del paciente o hacer visitas telefónicas cuando fuera posible. Otras medidas, como sacar a pacientes de estudios, creemos que no se han seguido en casi ningún centro.
Se tuvieron que parar las inclusiones de pacientes durante los meses de marzo y abril en prácticamente todos los ensayos clínicos. En mayo, con la reducción de la presión asistencial, se reiniciaron algunas las inclusiones y en junio ya se incluía en cualquier ensayo. Las visitas de inicio programadas durante los meses de confinamiento se tuvieron que posponer, y luego se hicieron más adelante, la mayoría de manera online. En cuanto a los Investigator Meeting, casi todos fueron cancelados y algunos se hicieron más adelante de manera online también.
Los pacientes de ensayo que eran COVID-19 positivos no pudieron recibir tratamiento hasta que no hubieran pasado varias semanas desde que no tuvieran síntomas. Por otro lado, los pacientes que no tenían COVID-19, algunos pedían expresamente que se les pospusiera el tratamiento por miedo a contagiarse o porque no podían viajar debido a las restricciones de desplazamiento. A pacientes que eran de más riesgo, se les retrasó el tratamiento o se utilizó al máximo la ventana del estudio para espaciar las visitas. También se retrasaron algunas pruebas de evaluación; éstas fueron permitidas por los laboratorios pero siempre pedían que se dejara señalado que la desviación de protocolo era debido a la pandemia.
Otra de las medidas tomadas fue revisar antes las analíticas de los pacientes, y se le llamaba para que no viniese si no se podía poner el tratamiento y había que posponerlo. También se hicieron algunos envíos de medicación oral o se entregaba la medicación a una persona designada por el paciente. Los laboratorios también permitieron que se hicieran los cuestionarios de calidad de vida de manera telefónica para reducir el contacto.
Muchas salas de monitorización fueron cambiadas de lugar para que los monitores no tuvieran que pasar cerca de pacientes recibiendo tratamiento o zonas de pacientes ingresados por COVID-19. Además, se implantó la firma electrónica en muchos documentos para todo el personal sanitario. Anteriormente era solo usado por el personal de la industria y por algunos jefes del servicio.
Impacto y adaptación en las CROs/industria
El principio de la pandemia fue un poco confuso para las CROs ya que cada hospital empezaba a implementar sus propias medidas de seguridad, entre ellas la cancelación de las visitas de monitorización. Además, los centros empezaron a hacer consultas sobre cómo gestionar o qué medidas aplicar si la situación iba a más, y desde las CROs y los promotores se comenzó a revisar los riesgos e impacto estudio por estudio para intentar adelantarse a posibles desviaciones. La situación mejoró un poco cuando la AEMPS emitió sus primeras recomendaciones el 16 de marzo (1), aunque ese primer documento planteaba algunas medidas sin desarrollarse profundamente.
Una de estas propuestas era la de implementar las monitorizaciones remotas o centralizadas en la medida de lo posible, e ir registrando que las desviaciones eran debidas a la pandemia del COVID-19. De esta manera se garantizaba el seguimiento del estudio, el cumplimiento del protocolo y la seguridad de los pacientes, evitando la visita presencial hasta que la situación mejorara. Por ello, una de las primeras medidas de las CROs fue la adaptación de los “Monitoring Plan” (los manuales para los monitores), para intentar incorporar de alguna forma ese seguimiento remoto de cada estudio.
Otra medida a la par de esta fue revisar de nuevo posibles riesgos debido a la pandemia y cómo minimizarlos, como por ejemplo la del envío de medicación a domicilio o adaptación de visitas presenciales a formato telefónico. Siempre se seguían las recomendaciones de la AEMPS (1), quien en abril y mayo fueron actualizando el famoso documento ampliando información en los puntos más relevantes. La última versión es del 1 de julio de 2020 y en ella ya se detallan de forma concreta cómo llevar a cabo cada uno de los puntos más críticos.
Las visitas presenciales se volvieron a permitir a finales de mayo, y se normalizó a prácticamente cualquier centro entre junio y julio. Cada hospital tenía y siguen teniendo sus propios protocolos para gestionar la visita del monitor. Estos van desde firmar unos documentos indicando que el monitor no presenta síntomas típicos de infección por COVID-19 o tomar la temperatura al llegar al centro hasta limitar el tiempo de interacción presencial con el personal del centro, llegando incluso a ser nulo con los data entry.
Otro impacto durante los primeros meses de la pandemia fue que la AEMPS priorizó la revisión de estudios relacionados con COVID-19 y, aunque no dejaron de revisar el resto, en algún momento hubo retrasos con la aprobación de protocolos para otras patologías. Por otro lado, el gran impacto asistencial del virus ha llevado al retraso de los inicios de los ensayos y, en las mejores situaciones, a realizar estas primeras visitas de forma remota.
Recomendaciones sobre qué medidas mantener en el futuro
Creemos que se debe aprovechar todos los cambios hechos durante la pandemia que han supuesto una mejora tanto para el paciente que participa en el ensayo como al personal involucrado en ellos, y mantenerlos en el futuro (Figura 1). Entre ellos se espera, por parte de los promotores, que los nuevos protocolos ofrezcan más flexibilidad para hacer visitas telefónicas, reducir pruebas poco necesarias o repensar los tiempos de realización de las mismas a períodos más amplios.
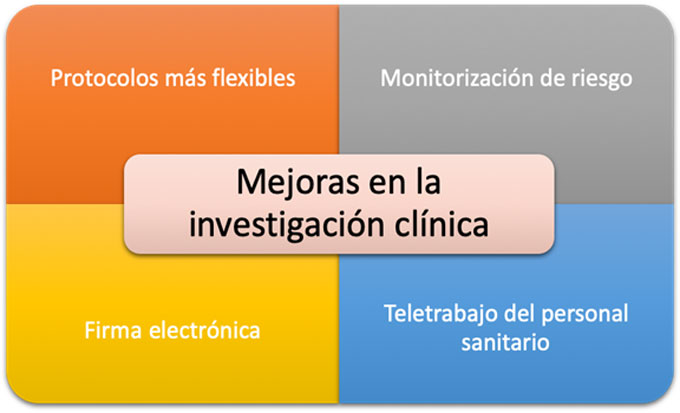
Figura 1: Recomendaciones sobre qué medidas tomadas durante la pandemia sería conveniente mantener en el futuro para mejorar la investigación clínica.
La implementación del teletrabajo en el hospital (en especial para los datas entries) ha sido uno de los cambios que más impacto ha tenido en el personal sanitario. Esta iniciativa debería de mantenerse con un acceso apropiado y protegido a los datos clínicos de los pacientes, y con una mejora en la digitalización de los documentos fuente.
Un paso muy importante que se ha dado es que las Agencias Reguladoras (EMA y AEMPS) han mostrado su apoyo a la implementación de la monitorización remota de los datos a pacientes. Es por ello que se deben de facilitar o crear herramientas para un acceso no presencial del monitor, siempre que se respeten las medidas de seguridad de protección de datos. Esto puede parecer un gran reto para los hospitales pero a la larga sería un gran avance en la monitorización de los ensayos, ya que permitiría acortar los tiempos de detección de problemas o posibles desviaciones menores recurrentes.
Otra de las grandes introducciones que esperemos que se quede ha sido la implementación de la firma electrónica de múltiples documentos. Esta herramienta ha ayudado a reducir los tiempos de firma presencial dado que el personal sanitario que participa en el ensayo normalmente se encuentra repartido en diferentes edificios y plantas del hospital.
Estos son los cambios más importantes que han ocurrido durante la pandemia y que consideramos que ha sido algo positivo que nos ha traído, a pesar de los momentos tan difíciles que hemos vivido. El personal sanitario, las CROs y las agencias reguladoras han hecho todo lo posible para que la investigación clínica no se detuviese por completo, y es por ello que deberíamos de acabar de asentar todos los cambios beneficiosos que se han realizado en estos últimos meses.
Referencias
1. Nota informativa de la AEMPS (16/03/2020, última actualización el 01/07/2020): Medidas excepcionales aplicables a los ensayos clínicos para gestionar los problemas derivados de la emergencia por COVID-19. www.aemps.gob.es/informa/notasinformativas/medicamentosusohumano-3/2020-medicamentosusohumano-3/medidas-excepcionales-aplicables-a-los-ensayos-clinicos-para-gestionar-los-problemas-derivados-de-la-emergencia-por-covid-19/















