La industria farmacéutica se vuelca con el medioambiente
En el período 2021-2023, las compañías farmacéuticas han desarrollado un total de 749 medidas de ecodiseño, ahorrando 2.800 toneladas de materias primas. También se ha logrado reducir un...
La Agencia Europea de Medicamentos (EMA) ha autorizado hasta el momento un total de 19 biosimilares de siete sustancias activas diferentes y pertenecientes a 11 compañías o grupos empresariales distintos, según se desprende de la información registrada por la EMA en su página web.
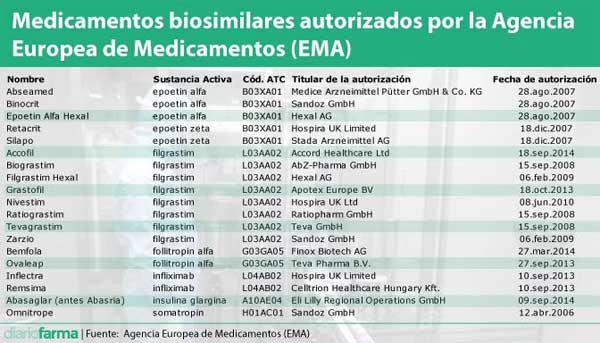
Se trata de medicamentos biosimilares de otros siete biológicos de referencia, en concreto, de epoetin alfa, epoetin zeta, filgrastim, follitropina alfa, infliximab, insulina glargina, somatropina. A ellos, habrá que sumar próximamente el etanercept, que Sandoz ya ha registrado.
En España, según los datos disponibles de la Agencia Española de Medicamentos (Aemps) se pueden encontrar disponibles todos los biosimilares autorizados por la EMA. En concreto, hay 94 presentaciones de los diferentes biosimilares disponibles, de las que 63 están comercializadas a día de hoy.
Los primeros biosimilares que llegaron a nuestro país fueron las presentaciones de somatropina, en 2006. Las últimas en estar disponibles para los médicos españoles han sido el infliximab, la insulina glargina y la folitropina alfa. Además, la Aemps califica como biosimilares, aunque no han tenido registro centralizado, los condroitín sulfato autorizados a Kern Pharma y Abamed, aunque aún no están comercializados ya que recibieron el visto bueno de la agencia en octubre y noviembre del pasado año y actualmente se encontrarán en fase de fijación de precio.
Por otro lado, cabe destacar que la EMA también ha iniciado la elaboración de guías para el desarrollo de biosimilares de interferón alfa recombinante o interferón alfa recombinante pegilado así como de factores estimuladores de colonias de granulocitos, o análogos de la insulina o insulinas humanas recombinantes, por lo que es de esperar que próximamente se realicen registros de estos productos, entre otros.
Fuente: diariofarma
En el período 2021-2023, las compañías farmacéuticas han desarrollado un total de 749 medidas de ecodiseño, ahorrando 2.800 toneladas de materias primas. También se ha logrado reducir un...
La Administración de los Servicios de Salud del Estado (ASSE), la Agencia Nacional de Investigación e Innovación (ANII) y la Dirección Nacional de Sanidad de las Fuerzas Armadas (DNSFFAA)...
Panamá y Costa Rica lideran la implementación regional de las buenas prácticas en la farmacovigilancia y la estandarización de los manuales de uso a través de sistemas utilizados en unos 112...
La semana pasada se celebró en la Sala Ausiàs March (Fundación Bancaja) una nueva conferencia del ciclo de debates organizado por Adamed Laboratorios, bajo el título 'Trazando un camino...