Los ensayos clínicos en humanos son el paso previo necesario para la comercialización de un fármaco o una nueva combinación en el mercado. Su éxito depende de si es eficaz y poco tóxico; sin embargo, es muy importante hacer un buen planteamiento del diseño del ensayo y toda su logística cuando se prueba en humanos, ya que hay variables más difíciles de controlar que cuando se testa en animales.
Un buen diseño no solo es imprescindible para valorar el fármaco correctamente, sino también para designar los recursos necesarios para la recogida de las variables secundarias y de investigaciones exploratorias futuras de la manera más óptima posible. Hay algunos aspectos claves en la logística del ensayo que favorecen el éxito del fármaco experimental y toda la investigación que deriva de su ensayo clínico (Figura 1).
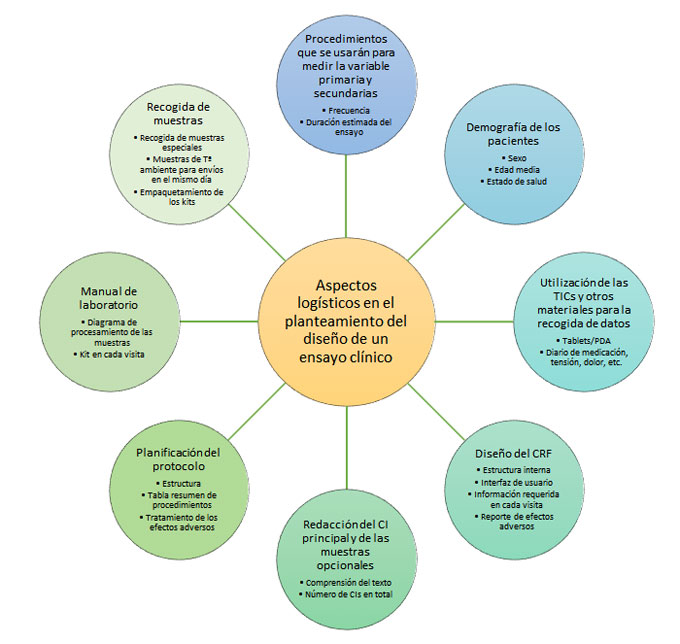
Figura 1: Resumen de diferentes aspectos logísticos a considerar en el planteamiento de un ensayo clínico. CI: consentimiento informado; CRF: del inglés case report form (cuaderno de recogida de datos); PDA: del inglés personal digital assistance; Tª: temperatura; TIC: tecnologías de la información y de la comunicación.
Lo primero de todo que hay que tener en cuenta para su planteamiento es que los ensayos clínicos se realizan con personas que tienen sus rutinas diarias, y en hospitales donde suele haber un alto volumen de trabajo, tanto asistencial como de investigación. Es por esto que hay que pensar cuidadosamente cómo se va a medir la variable o variables principales, la frecuencia con la qué se va a pedir dentro del ensayo, teniendo en cuenta la duración estimada de éste. Y lo mismo con las variables secundarias y de investigaciones futuras. Porque cuantos más procedimientos se incluyan en el protocolo, más probable es que se puedan olvidar, haya errores o que no se puedan cumplir por los propios circuitos internos del hospital. En ocasiones, por poner un ejemplo, el enorme número de cuestionarios y la frecuencia de algunas pruebas han llegado a ser excesivos para los pacientes, sobre todo aquellos que estaban mucho tiempo dentro del ensayo.
Es importante poder predecir, aproximadamente, la edad media, el sexo y el estado de salud de los pacientes que van a participar en el ensayo clínico. Teniendo en cuenta esto uno se puede llegar a hacer una idea del perfil del paciente y su posible situación laboral y familiar, ya que pueden ser determinantes para el cumplimiento de los procedimientos del ensayo. Siempre debemos de preservar la intimidad e integridad del paciente tratando de no alterar demasiado su calidad de vida debido al cumplimiento del protocolo. Además, esto nos puede ayudar a elegir qué y cuantos materiales se podrían usar convenientemente en el estudio. Aquellos ensayos que requieren apuntar en un móvil la medicación para los efectos secundarios y dolor, rellenar el diario de medicación en papel y completar el cuestionario de calidad de vida en tablets en cada ciclo, puede llegar a ser muy complicado para los pacientes, especialmente aquellos que no se saben manejar bien con aparatos electrónicos.
En estos últimos años ha habido un gran avance en la digitalización de algunos documentos fuente y del archivo del investigador. Un cambio trascendental fue la digitalización del CRD (cuaderno de recogida de datos o CRF “case report form”), que ha permitido que se pueda revisar remotamente para detectar errores muy evidentes o solicitar valores ausentes, entre otras muchas cosas. Es indispensable que este CRF sea una plataforma con una estructura interna comprensible y con una interfaz de usuario agradable, ya que de esta manera los datos se entrarán más rápido y con menos errores. La complejidad de algunos CRFs hace difícil saber dónde se tienen que responder las queries o obliga a tener que entrar en muchas páginas para poder reportar un efecto adverso serio. Estos CRFs tan confusos y enrevesados suelen causar mucha frustración y quita tiempo al personal sanitario para otras actividades. Otro de los errores en el diseño de un CRF es pedir demasiada información de la cual podría no ser muy importante, no se fuera a analizar en el futuro o estuviera repetida en varias pestañas. Aunque el reporte de esta información parece no quitar mucho tiempo, si se multiplica por cada ciclo y por cada paciente pueden llegar a ser bastantes horas, especialmente si implica modificar las hojas de enfermería para añadir la variable que falta o pedir adendas al médico.
También es muy importante el diseño de otros documentos del ensayo, ya sean digitales o en papel. El consentimiento informado, por ejemplo, debe ser claro, conciso y con palabras sencillas para que las pueda comprender el paciente. Si hay varios procedimientos opcionales que se necesita su consentimiento, siempre es mejor que se incluya en el consentimiento general o que sea en el menor número de consentimientos opcionales posible. Si se hace uno para cada procedimiento opcional, hay probabilidades de que se pueda olvidar alguno. Otro ejemplo es el protocolo, que se consulta muy a menudo y muchas veces con prisa ya que el paciente está esperando en consulta. El protocolo debería de estar bien estructurado y redactado para poder encontrar y comprender la información referente al fármaco (manejo de los efectos secundarios o medicaciones concomitantes prohibidas), así como tener un formato de la tabla resumen de los procedimientos muy claro y comprensible. Esto último es clave ya que los médicos suelen participar en muchos más ensayos que los coordinadores, y no tienen memorizados todos los procedimientos.
Otro documento muy importante es el manual de laboratorio, que explica el procesamiento de todas las muestras del estudio. Normalmente es usado por enfermería, pero también por otros servicios como anatomía patológica. Este documento tendría que explicar en detalle qué kit hay que usar en cada visita, como se tiene que procesar cada tipo de muestra y a qué temperatura se almacena. No es muy práctico que en un mismo kit venga los albaranes o tubos que necesitan los diferentes servicios (por ejemplo, enfermería y anatomía patológica). Por otro lado, estos últimos años, en patologías como el cáncer, se ha incrementado mucho el tipo de muestras a recoger, donde además de las muestras típicas de PKs o biomarcadores se están recogiendo muestras para ctDNA (circulating tumor DNA, más conocido como biopsia líquida), TCR (T cell receptor, para el estudio de clones de linfocitos T) o heces (para el estudio de la microbiota) que requieren tubos especiales. Además, muchas de estas muestras se tienen que enviar el mismo día y por tanto exigen mayor atención, especialmente cuando el tratamiento se pone por la tarde y no es enfermería quien se encarga del envío sino coordinación.
En resumen, creo que hacer un buen planteamiento de los procedimientos de un ensayo clínico es fundamental para designar recursos óptimos que garanticen el éxito del fármaco experimental. Además, permitirá hacer estudios robustos con las muestras y los datos obtenidos dentro del ensayo. Sería muy recomendable contar con la opinión de personal sanitario involucrado en la logística de los ensayos a la hora de diseñar un protocolo, especialmente si se van a incluir pruebas o muestras no muy habituales. De esta manera se podrá abordar el diseño desde una perspectiva realista y eficaz.














