LEO Pharma recibe la opinión positiva del CHMP sobre tralokinumab para el tratamiento de adultos con dermatitis atópica de moderada a grave
Si se autoriza, será el primer producto biológico aprobado que se dirija específicamente a la citoquina IL-13, un factor clave de los signos y síntomas de la dermatitis atópica.
La opinión del Comité de Medicamentos de Uso Humano o CHMP se basa principalmente en los datos de los estudios ECZTRA 1, 2 y ECZTRA 3, incluidos en la solicitud de autorización de comercialización.
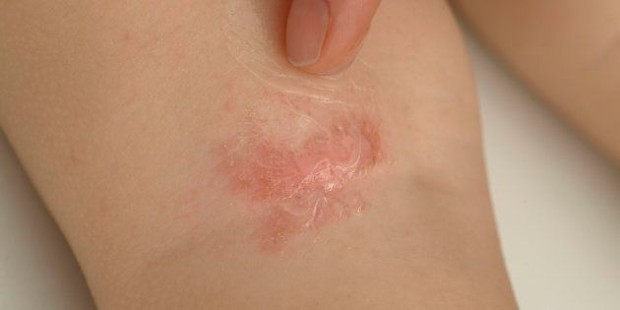
LEO Pharma, líder mundial en dermatología médica, ha anunciado que el Comité de Medicamentos de Uso Humano (CHMP son sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA) ha emitido una opinión positiva y ha recomendado otorgar la autorización de comercialización de tralokinumab –cuyo nombre comercial es Adtralza– para el tratamiento de la dermatitis atópica de moderada a grave en pacientes adultos candidatos a tratamiento sistémico.
La opinión positiva del CHMP es uno de los pasos finales antes de que la Comisión Europea tome su decisión sobre la solicitud de autorización de comercialización para el uso de tralokinumab, una terapia en investigación, en toda la Unión Europea. En los próximos meses se espera la decisión final. En caso de lograr la autorización, sería el primer anticuerpo monoclonal completamente humano disponible para neutralizar específicamente la citoquina IL-13, un factor clave en la sintomatología de la dermatitis atópica. Esta nueva terapia neutraliza específicamente a la IL-13 con una alta afinidad y está desarrollada para mejorar los síntomas de la dermatitis atópica, una enfermedad inflamatoria crónica y compleja de la piel.
“La dermatitis atópica se caracteriza por su imprevisibilidad, lo que puede ser un desafío para los pacientes que a menudo experimentan malestar físico y efectos emocionales que pueden continuar durante décadas”, explica Jörg Möller, vicepresidente ejecutivo de Investigación y Desarrollo Global de LEO Pharma. “La opinión del CHMP acerca un paso más a LEO Pharma hacia la posibilidad de ofrecer una nueva opción terapéutica para los pacientes de la Unión Europea que viven con dermatitis atópica de moderada a grave”, añade Möller.
La opinión del CHMP se basa principalmente en datos de tres estudios pivotales, aleatorizados, doble ciego y controlados con placebo: ECZTRA 1, 2 y ECZTRA 3. En ellos se evaluó la eficacia y seguridad de este anticuerpo monoclonal tanto en monoterapia (ECZTRA 1 y 2) como en combinación con corticosteroides tópicos (TCS) (ECZTRA 3) en más de 1.900 pacientes adultos con dermatitis atópica de moderada a grave. Los criterios de valoración principales fueron la puntuación de la evaluación global del investigador de piel blanqueada o casi blanqueada (IGA 0/1) y al menos una mejora del 75% en la puntuación del Índice de Severidad y Área del Eccema (EASI-75).
Los criterios de valoración secundarios, que incluían la extensión y la gravedad de las lesiones cutáneas, el prurito o picor, el sueño y las medidas de calidad de vida relacionadas con la salud, fueron medidos mediante cambios en las puntuaciones EASI-90, SCORing Atopic Dermatitis (SCORAD), escala de calificación numérica del prurito (NRS), NRS del sueño relacionado con el eccema e Índice de Calidad de Vida Dermatológica (DLQI). Los ensayos demostraron que esta nueva terapia cumplía los criterios de valoración de eficacia tanto primarios como secundarios y que, en general, se toleraba bien.
A la espera de la decisión final de la Comisión Europea, la autorización de comercialización será válida en todos los estados miembros de la Unión Europea, así como en Islandia, Noruega y Liechtenstein. Del mismo modo se están llevando a cabo presentaciones reglamentarias ante la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y otras autoridades sanitarias en todo el mundo.










 &
& 
