LEO Pharma anuncia la aprobación por parte de la Comisión Europea de Adtralza (tralokinumab), un tratamiento biológico innovador para adultos con dermatitis atópica de moderada a grave
Es la primera y única terapia biológica dirigida específicamente a inhibir la citoquina IL-13, un factor
clave en los signos y síntomas de esta enfermedad inflamatoria y crónica de la piel.
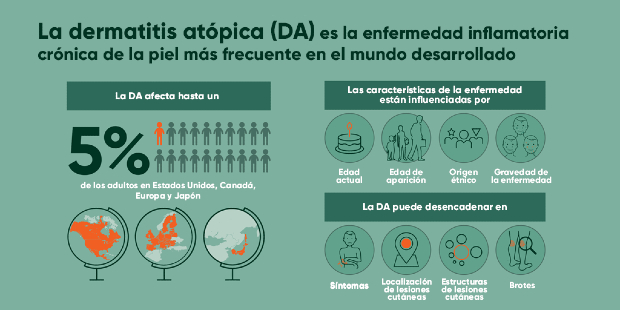
LEO Pharma, líder mundial en dermatología médica, anunció hoy que la Comisión Europea (CE) ha aprobado Adtralza (tralokinumab) para el tratamiento de la dermatitis atópica de moderada a grave en pacientes adultos que son candidatos a tratamiento sistémico. La autorización de la Comisión Europea lo convierte en el primer anticuerpo monoclonal humanizado de alta afinidad aprobado específicamente para bloquear e inhibir la citoquina IL-13, un factor clave de los signos y síntomas de la dermatitis atópica, ofreciendo una nueva opción terapéutica para el manejo de la dermatitis atópica, la enfermedad inflamatoria crónica más común de la piel6 y que afecta a entre el 2,1% y el 4,9% de la población adulta en países como España.
El medicamento estará disponible en jeringa precargada con 150 mg/ml para inyección subcutánea con una dosis inicial de 600 mg seguida de 300 mg en semanas alternas. Este medicamento puede usarse con o sin corticosteroides tópicos (TCS) .
“La autorización de la Comisión Europea significa que los médicos de toda Europa tienen ahora una importante nueva opción de tratamiento para pacientes adultos con dermatitis atópica de moderada a grave, una enfermedad cutánea crónica e impredecible”, según Stephan Weidinger, del Departamento de Dermatología y Alergia del Hospital Universitario Schleswig-Holstein en Kiel (Alemania) e investigador clínico de tralokinumab. "Al dirigirse específicamente a la IL-13 con una alta afinidad, ha demostrado que puede reducir los signos y síntomas de la dermatitis atópica y mantener estas mejoras en el tiempo".
La aprobación se basa principalmente en los resultados de eficacia y seguridad de los ensayos pivotales de fase 3 ECZTRA 1, 2 y ECZTRA 3, que incluyeron a más de 1.900 pacientes adultos con dermatitis atópica de moderada a grave. Los datos de seguridad se evaluaron a partir de un grupo de cinco ensayos aleatorizados, doble ciego y controlados con placebo, incluidos ECZTRA 1, 2 y ECZTRA 3, un ensayo de rango de dosis y un ensayo sobre el efecto en la respuesta de vacunas.
“La autorización de la Comisión Europea es un avance importante para los millones de adultos en Europaque conviven con esta enfermedad de la piel, a menudo incontrolada”, ha explicado Catherine Mazzacco, presidenta y directora ejecutiva de LEO Pharma. "Estamos orgullosos de tener la oportunidad de ofrecer una nueva opción de tratamiento a largo plazo para la dermatitis atópica de moderada a grave y estamos trabajando para asegurar el acceso para los pacientes”.
La decisión de la Comisión Europea es válida en todos los estados miembros de la Unión Europea, Islandia, Noruega y Liechtenstein. Se están realizando presentaciones reglamentarias adicionales ante la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido y otras autoridades sanitarias de todo el mundo.










 &
& 
