Consecuencias del estrés oxidativo sobre la piel
Según los expertos de la firma de dermocosmética Toskani, el estrés oxidativo es uno de los principales desencadenantes del envejecimiento prematuro de la piel. Combinar tratamientos en clínica...
Es la primera y única vacuna contra el VRS aprobada en la Unión Europea (UE) tanto para adultos mayores como para la inmunización de mujeres embarazadas con el fin de ayudar a proteger a sus bebés desde el nacimiento hasta los seis meses de edad.
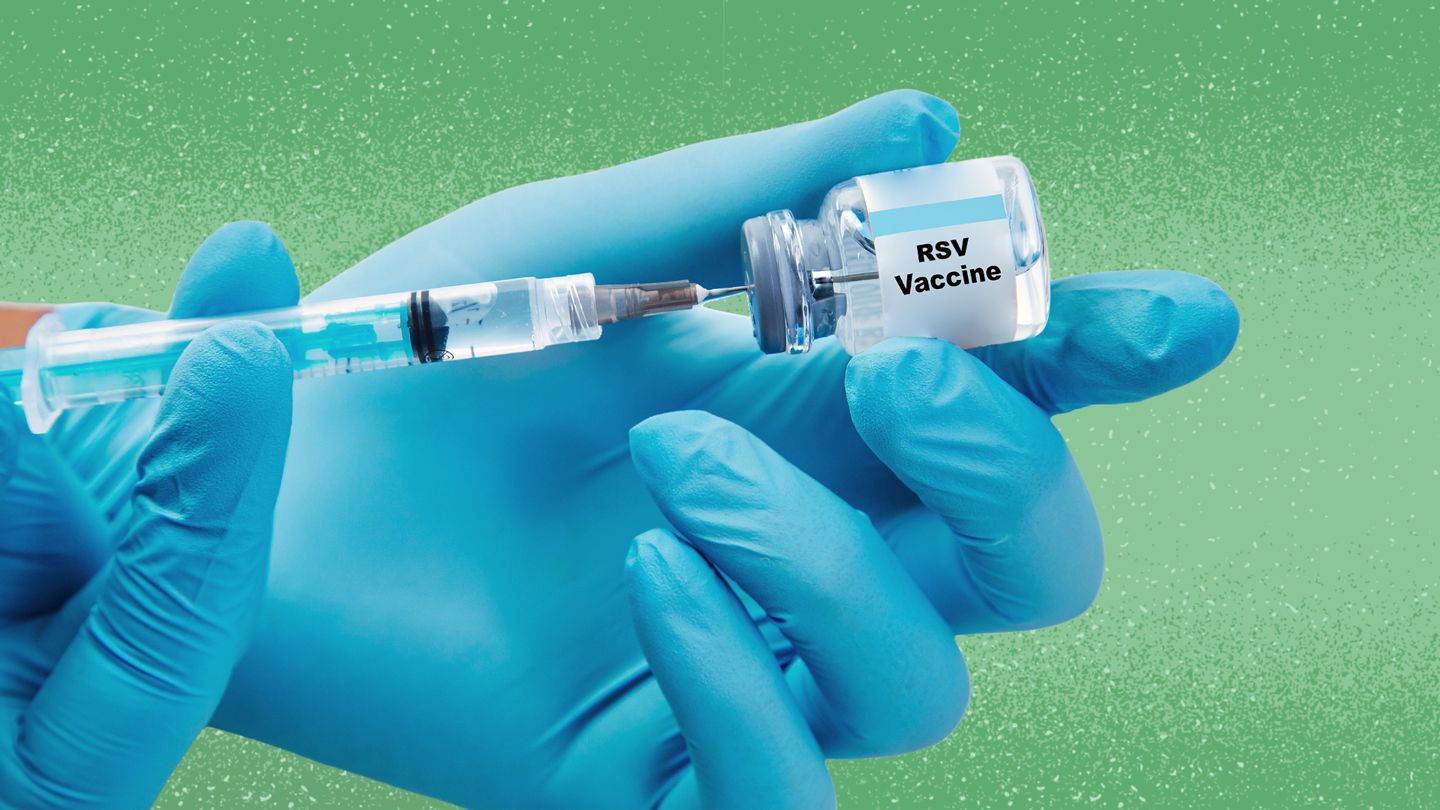
Pfizer ha anunciado que la Comisión Europea (CE) ha concedido la autorización de comercialización de Abrysvo, la vacuna bivalente de la compañía contra la proteína F en prefusión (RSVpreF) para conferir protección frente al virus respiratorio sincitial (VRS) tanto en lactantes mediante la inmunización activa de embarazadas como en adultos mayores. ABRYSVO está indicada para:
· La protección pasiva contra las enfermedades de las vías respiratorias inferiores (ERVBI), causadas por el VRS en lactantes desde el nacimiento hasta los seis meses de edad, mediante la inmunización de las mujeres durante el embarazo.
· La inmunización activa de las personas mayores de 60 años para la prevención de las ERVBI causadas por el VRS.
"La aprobación de Abrysvo en Europa supone un avance representativo de los esfuerzos de la comunidad científica por proporcionar una protección significativa contra el VRS, un virus respiratorio común que puede ser potencialmente grave e incluso mortal, especialmente para los lactantes y los adultos mayores", ha declarado la Dra. Annaliesa Anderson, doctora, vicepresidenta senior y directora de Investigación y Desarrollo de Vacunas de Pfizer. "El importante número de recién nacidos, niños y adultos hospitalizados el año pasado en toda Europa demostró la inmensa necesidad de protección frente a los casos de VRS graves. La aprobación de la vacuna tanto para adultos mayores como para lactantes a través de la inmunización de las mujeres embarazadas es un triunfo para la salud pública y esperamos ver un tremendo impacto en las próximas temporadas".
Esta autorización de comercialización sigue al reciente dictamen positivo del Comité de Medicamentos de Uso Humano (CHMP). La autorización es válida en los 27 Estados miembros de la UE más Islandia, Liechtenstein y Noruega. Abrysvo es la primera vacuna autorizada que se ha diseñado y estudiado explícitamente para la inmunización de embarazadas y ahora se podrá administrar una sola dosis de la vacuna en la UE entre las semanas 24 y 36 de gestación.1 Además, Abrysvo se ha estudiado en adultos mayores de 60 años. La autorización de comercialización incluye el uso de una dosis única también en esta población.
La autorización de comercialización de Abrysvo en la UE está basada en los resultados de dos ensayos clínicos de fase 3: RENOIR2 (RSV vaccine Efficacy study iN Older adults Immunized against VRS disease) y MATISSE3 (MATernal Immunization Study for Safety and Efficacy).
RENOIR (NCT05035212) es un estudio global, aleatorizado, doble ciego, controlado con placebo, que ha sido diseñado para evaluar la eficacia, inmunogenicidad y seguridad de una dosis única de la vacuna en adultos mayores de 60 años. Por otro lado, MATISSE (NCT04424316) es un estudio global, aleatorizado, doble ciego, controlado con placebo, que ha sido diseñado para evaluar la eficacia, seguridad e inmunogenicidad de RSVpreF contra ERVBI y ERVBI graves provocadas por el VRS en lactantes nacidos de mujeres sanas vacunadas durante el embarazo.
Según los expertos de la firma de dermocosmética Toskani, el estrés oxidativo es uno de los principales desencadenantes del envejecimiento prematuro de la piel. Combinar tratamientos en clínica...
La apertura del evento estuvo a cargo de Nely Corzo, Gerente General de Tuteur Bolivia y Antonio Avila Nieves Director Comercial de Tuteur Latam. Con la presencia de destacados...
La compañía biofarmacéutica vizcaína, que prevé lanzar su primer medicamento biológico al mercado en el primer semestre de 2025, destinará los fondos a ampliar su capacidad de producción y...
Elranatamab llega para dar respuesta a estos pacientes que hayan recibido al menos tres terapias previas, y hayan demostrado progresión de la enfermedad tras la última terapia. El...