Bajo la Directiva de productos sanitarios (MDD) y la Directiva de productos sanitarios de diagnóstico in-vitro (IVDD), el software de productos sanitarios (MDSW) se ha considerado generalmente de bajo riesgo y, por tanto, con una clasificación baja. En concreto, la MDD consideraba que el MDSW era un producto sanitario activo, según las normas 9 a 12 (anexo IX, sección III), con un resultado que podía ir de la clase I a la clase IIb. En la práctica, los softwares solían clasificarse como DM de clase I. La IVDD, en cambio, se consideraba un IVD "general/de otro tipo", excepto si estaba destinado a evaluar el riesgo de trisomía 21, en cuyo caso estaba en la lista B (anexo II).

Con la plena aplicación del MDR y la proximidad de la fecha de aplicación del IVDR, el 26 de mayo de 2022, es probable que los MDSW obtengan una mayor clasificación. En particular, el software autónomo recibe más atención en el Reglamento de la UE 2017/745 (MDR) y el Reglamento de la UE 2017/746 (IVDR).
Reglas de clasificación del Software bajo el IVDR y MDR
El MDR contiene una regla de clasificación específica para el software autónomo: Regla 11 (Anexo VIII).
“Los programas informáticos destinados a proporcionar información que se utiliza para tomar decisiones con fines terapéuticos o de diagnóstico se clasifican en la clase IIa, salvo si estas decisiones tienen un impacto que pueda causar:
— la muerte o un deterioro irreversible del estado de salud de una persona, en cuyo caso se clasifican en la clase III, o
— un deterioro grave del estado de salud de una persona o una intervención quirúrgica, en cuyo caso se clasifican en la clase IIb.
Los programas informáticos destinados a observar procesos fisiológicos se clasifican en la clase IIa, salvo si se destinan a observar parámetros fisiológicos vitales, cuando la índole de las variaciones de dichos parámetros sea tal que pudiera dar lugar a un peligro inmediato para el paciente, en cuyo caso se clasifican en la clase IIb.
Todos los demás programas informáticos se clasifican en la clase I.”
En cambio, en el IVDR las normas de clasificación son ligeramente diferentes. En este reglamento, el software se clasifica según la clase del dispositivo al que acompaña o sobre el que influye. Además, el IVDR no contiene una norma de clasificación específica para el software independiente. La norma de aplicación del IVDR 1.4 (anexo VIII) establece que:
“Los programas informáticos que sirvan para manejar un producto o tengan influencia en su utilización se incluirán en la misma clase que el producto.”
Documento de orientación adicional del MDCG para la clasificación del software
Según la regla 11 del MDR, la clasificación de los programas informáticos autónomos puede ir de la clase I a la clase III en función del impacto de la información proporcionada por el programa informático. Esta norma no ofrece una interpretación literal. Por lo tanto, para evitar la inseguridad jurídica relacionada, se sugiere el marco de riesgo IMDRF para ayudar en la clasificación. Este marco se ha adoptado para el MDR en el MDCG 2019-11, que proporciona una tabla que facilita la clasificación de los dispositivos basada en: (1) la importancia de la información proporcionada por el MDSW para una situación sanitaria relacionada con el diagnóstico/la terapia; y (2) el estado de la situación sanitaria o la condición del paciente. Curiosamente, la clase I no aparece en la tabla, lo que sugiere que, según la clase I del MDR, los MDSW serán poco frecuentes y los programas informáticos tenderán a tener una clasificación de mayor riesgo.
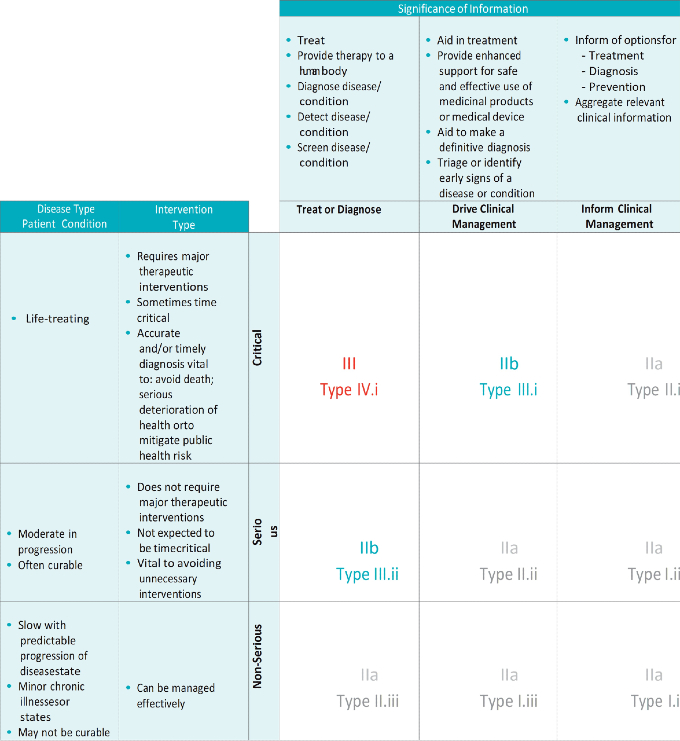
Figura 1. Fuente: Grupo BSI. Software as a Medical Device (Baird and Cobbaert, 2020)
El MDCG 2019-11 establece que las normas de aplicación (el anexo VIII del MDR, la norma de aplicación 3.3, o el anexo VII del IVDR, la norma de aplicación 1.4) también deben tenerse en cuenta como orientación para encontrar la clasificación correcta del software que impulsa o influye en el uso de un dispositivo. Por lo tanto, un MDSW que cumple su finalidad prevista y a la vez impulsa o influye en el uso de otro DM con fines médicos se clasifica por sí mismo, en función de la finalidad prevista que se haya alcanzado. Sin embargo, en tal caso, la clase de riesgo no será inferior a la clase de riesgo del DM.
En esta directriz, también se consideran relevantes para todos los productos las normas de aplicación 3.5 y 1.9 (Anexo VIII del MDR o Anexo VII del IVDR, respectivamente), que establecen:
"Si a un mismo producto se le aplican varias normas o, dentro de la misma norma, varias subreglas, en función de la finalidad prevista del producto, se aplicará la norma y la subregla más estrictas que den lugar a una clasificación más elevada".
Diferencia entre la versión IEC 62304 de la clasificación del software y la clasificación MDR/IVDR
Además del MDR y la IVDR, hay otras normas que hay que tener en cuenta a la hora de clasificar la clase de riesgo de los MDSW. La IEC 62304 es una norma europea armonizada y especifica los requisitos del ciclo de vida para el desarrollo de MDSW. El sistema de clasificación de la IEC 62304 se centra en la seguridad y es independiente de los sistemas de clasificación del MDR y el IVDR.
En general, el MDR define las clases I, IIa, IIb y III en función del riesgo que presenta el dispositivo. Por su parte, el IVDR define las clases A a D, donde la clase A incluye los dispositivos no críticos y la clase D los dispositivos más críticos. La seguridad del software según la norma IEC 62304 se divide en tres clases:
• Clase A: Si el software no puede causar ningún daño.
• Clase B: Si el software puede causar daños menores, como lesiones.
• Clase C: Si el software puede causar daños importantes, como lesiones graves o incluso la muerte.
La clase de seguridad del software determina la cantidad y especificidad de la documentación del software requerida de la siguiente manera:
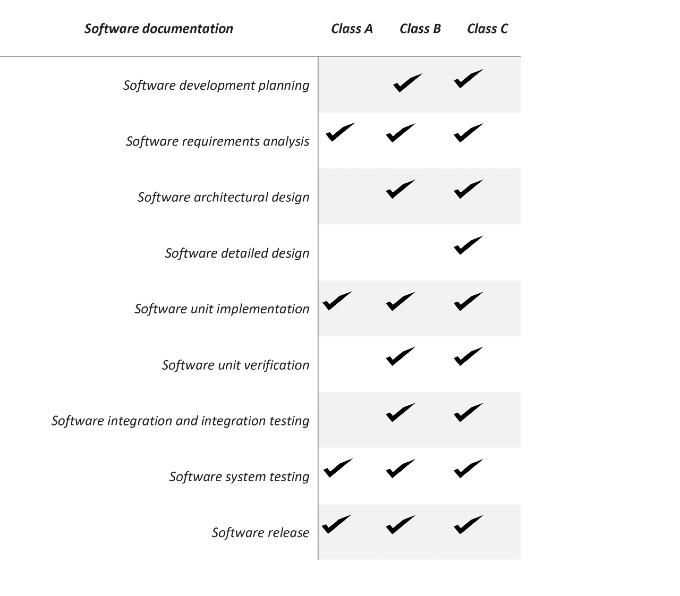
Figura 2 Resumen de los requisitos para la MDSW basados en la norma IEC62304.
Observaciones finales
Teniendo en cuenta el creciente número y complejidad de los MDSW, su clasificación debe realizarse con cuidado. Las normas de clasificación detalladas en el MDR y el IVDR proporcionan los requisitos que ayudan a los fabricantes y a las agencias a navegar por un sistema bien establecido. Al mismo tiempo, las directrices también animan a los fabricantes a adoptar medidas continuas de protección de datos.
Garantizar una clasificación precisa, una evidencia clínica adecuada y unos procedimientos de mitigación de riesgos apropiados desempeñan un papel fundamental a la hora de abordar y mejorar la seguridad del paciente y el rendimiento del dispositivo para comercializarlo con éxito.
En AKRN Scientific Consulting SL somos expertos en MDSW. Podemos ayudar a los fabricantes a preparar o actualizar la documentación requerida para cumplir con los requisitos del MDR o IVDR para obtener o mantener el marcado CE.
















