Una de las principales preocupaciones en el entorno sanitario es la sostenibilidad de un sistema sanitario público tal como lo conocemos. Dadas las circunstancias económicas actuales, se antojan necesarios nuevos modelos de gestión para la prestación farmacéutica que contemplen esquemas de acceso del paciente a la innovación. En este contexto, los acuerdos de riesgo compartido basados en pago por resultados en salud, suponen una fórmula novedosa capaz de garantizar la sostenibilidad del sistema y la apertura a la innovación biofarmacéutica.
Según el Boletín de Coyuntura del Mercado Farmacéutico en España, publicado por Farmaindustria, el gasto farmacéutico en España representó en 2013 aproximadamente el 0,9% del PIB y alcanzó el 14,5% del gasto sanitario público. Si bien es verdad que esta cifra es la más baja desde que existen registros, 1983, no deja de ser un componente esencial del mantenimiento de un sistema sanitario, reconocido internacionalmente como uno de los mejores en cuanto a cobertura de la población y calidad asistencial. Sin embargo, el impacto de la crisis económica y el consecuente descenso en los ingresos del erario público, ha provocado un retraso en cuanto a la velocidad de integración en el sistema de la innovación tanto en cuanto a tecnologías sanitarias como en medicamentos.
En un reciente informe llevado a cabo por EFPIA en 2011, denominado WAIT, el cual registra el tiempo medio entre el momento de la aprobación de un nuevo medicamento por la Comisión Europea y su adopción por los sistemas públicos sanitarios, España aparece en una posición intermedia con 360 días requeridos como media para su inclusión en la financiación con fondos públicos. Esta media es similar a la que tiene Italia, pero está alejada de otros estados como Reino Unido o Alemania, donde la incorporación de la innovación biofarmacéutica al sistema es prácticamente inmediata. Es cierto, además, que en los últimos años este desequilibrio se ha acentuado, entre otras razones por el elevado valor económico de los nuevos medicamentos, casi todos ellos dirigidos al tratamiento de enfermedades oncológicas, infecciosas (virales) y autoinmunes, enfermedades con una importante carga social e incapacitantes.
La adopción de estos tratamientos supone para el gestor de la salud un reto importante. Por una parte, el paciente, como eje del sistema, tiene que tener un acceso preferente al tratamiento que puede resolver su situación clínica, de otra, el sistema público debe optimizar sus recursos para garantizar la asistencia a todos los asegurados y hacer sostenible el sistema público de salud en condiciones de equidad.
Ante esta perspectiva resulta imprescindible abordar un nuevo modelo de gestión para la prestación farmacéutica que contemple la aplicación de esquemas de acceso a la innovación que garanticen que las nuevas tecnologías son seguras, eficaces y eficientes. Es decir, su introducción debe ser entendida como “inversión en salud” mejorando la relación coste efectividad frente a las alternativas existentes.
En este sentido, algunos sistemas sanitarios han puesto en marcha distintos programas que mejoran la relación coste efectividad de las nuevas aportaciones a la terapéutica. Son denominados genéricamente acuerdos innovadores entre el proveedor y el financiador, que persiguen compartir el riesgo que supone para el primero el retraso en su introducción en el mercado y las condiciones económicas y de acceso. Para el gestor la incorporación de un fármaco nuevo, en términos de epidemiología, incremento de las partidas presupuestarias destinadas a esa patología, y sobre todo la incertidumbre asociada a lo nuevo, en cuanto a eficacia en la práctica clínica habitual. En definitiva, un esquema de acceso basado en acuerdos entre la industria y el gestor sanitario que busca cambiar la relación clásica de cliente suministrador, por un vínculo más estrecho, en el que las dos partes desean colaborar para lograr una meta común: el tratamiento de aquellos pacientes que se verán beneficiados con la nueva alternativa en un entorno coste efectivo.
Diversidad de modelos
Existen distintos modelos que pueden ser ejemplos de colaboración entre el gestor público y el proveedor privado, unos con mayor complejidad que otros. La siguiente tabla viene a resumir algunas experiencias que han sido propuestas o aplicadas:
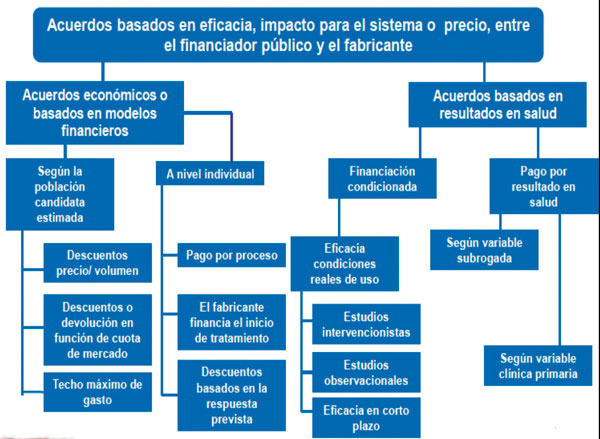

Cada uno de estos esquemas es aplicable en función de determinadas condiciones que vienen dadas por la complejidad del tratamiento de la enfermedad en la cual pretende emplearse el nuevo medicamento, en todo caso creemos que, al desplazarnos en la tabla desde la izquierda hacia la derecha, vamos creando valor para el paciente, para el financiador público y para el fabricante.
Riesgos a asumir
Es el momento de preguntarnos: ¿Por qué un esquema de acceso que incluya riesgo compartido? La respuesta es sencilla: Es necesario plantear un acuerdo de riesgo compartido si no existe un método fiable para predecir el resultado en salud en un paciente expuesto a una intervención clínica de alto impacto, o si el resultado en salud esperado no responde a las expectativas del gestor público.
De este modo, el fabricante, que conoce el medicamento que ha desarrollado, está preparado para asumir el riesgo de fracaso inherente al uso en condiciones distintas a las planteadas en un ensayo pivotal, en el cual los pacientes reclutados, responden a un perfil delimitado por el promotor del ensayo para garantizar la homogeneidad de la muestra, están exentos de comorbilidades que pueden enmascarar o modificar la respuesta, el seguimiento es estricto y el cumplimiento terapéutico asegurado. Esto es lo más semejante a un “mundo ideal”.
El financiador público, por su parte, ha de aceptar compensar adecuadamente al fabricante por el valor que aporta el medicamento al enfermo, una vez que ha traslado al fabricante el riesgo asociado a la eficacia en la práctica clínica diaria. Además, debe soportar la incertidumbre relacionada con la epidemiología de la enfermedad a tratar que se verá alterada por la aplicación de la nueva tecnología, asegurando que todos los pacientes candidatos a recibir este tratamiento tendrán acceso al mismo.
UCB Pionero
En UCB hemos sido pioneros en la implementación de acuerdos de riesgo compartido basados en resultados en salud, siguiendo el binomio si cura, se paga. En España comenzamos a negociar estos programas hace dos años y, hasta la fecha, llevamos implementados más de una veintena de estos acuerdos con hospitales públicos en siete Comunidades Autónomas, como más adelante comentaremos estos programas cumplen las tres condiciones básicas para su aplicación, sencillez en la valoración de resultados, utilización de variables manejadas en la práctica médica habitual y simplicidad en el acuerdo económico para la devolución del coste de los pacientes que no han recibido el beneficio esperado . Y, acabamos de cerrar, hace unos meses, otro pacto similar con Infarmed en Portugal para establecer este tipo de acuerdos con todos los hospitales del sistema público portugués.
Es verdad, que un acuerdo de riesgo compartido o bien de pago por resultados en salud, solo tiene sentido cuando los beneficios esperados, en términos económicos o de coste efectividad, superan los recursos implicados en su puesta en marcha. Por lo tanto, un esquema de pago por resultados podría plantearse en tres circunstancias:
-
La relación coste efectividad incremental está por encima de lo aceptable por el Sistema.
-
Si la nueva tecnología propuesta genera un alto impacto, pero existe confianza entre las partes en cuanto al beneficio potencial de un acuerdo de riesgo compartido clínico.
-
O si la incertidumbre de los resultados condiciona la introducción en la Guía Farmacoterapéutica del gestor sanitario.
Existen otros tipos de esquemas de acceso innovadores que se adecuan mucho más a situaciones diferentes a las anteriormente descritas:
-
Si la relación coste efectividad incremental es aceptable para el gestor o está muy cerca de serlo, un acuerdo de pago tradicional, puede ser recomendable.
-
Si existe un riesgo real de precio diferencial con otros mercados debido a un inaceptable ratio coste efectividad, los acuerdos de precio al sistema nacional de salud, es una alternativa.
-
En casos de intervenciones de alto impacto, pero baja prevalencia, acuerdos de techo de gasto entre el financiador y el fabricante.
-
Riesgo de precio inferior al esperado por limitada experiencia clínica, acuerdos de precio condicionado a generación de evidencia.
-
Incertidumbre sobre el impacto presupuestario a corto plazo, descuentos por volumen, en función del consumo.
Principales ventajas
Si en este momento nos planteásemos si un programa de acceso basado en la retribución al proveedor según los resultados en salud obtenidos con su producto, conlleva beneficios para todos los intervinientes en el proceso de generación de salud, nos damos cuenta inmediatamente que es así:
Para el paciente, un acuerdo de riesgo compartido implica un seguimiento más personalizado, evidentemente nunca tan estricto como un ensayo clínico controlado, una monitorización más cercana incrementa el cumplimiento terapéutico y de esta manera se asegura su eficacia, evita gastos innecesarios al sistema y así permite que un mayor número de enfermos pueda acceder de manera más rápida a la innovación; y finalmente, se reduce el tiempo de exposición a un medicamento potencialmente no eficaz.
El gestor público podrá gestionar con mayor precisión el presupuesto que maneja, evolucionando desde el modelo clásico cliente/suministrador hacia un modelo mucho más transparente y colaborativo, reduce la incertidumbre relacionada con la eficacia, paga solo por el resultado obtenido, enfoca su gestión en la búsqueda de resultados lo que implica inversión en salud frente al gasto, y libera recursos para permitir la introducción de intervenciones innovadoras.
Para el fabricante se agiliza el acceso de la innovación a un coste razonable sin poner en riesgo otros mercados, obtiene datos sobre resultados en salud en práctica clínica real, mejora la percepción del clínico sobre la confianza en el medicamento, alcanza una relación de socio estratégico con el financiador público, y asegura una utilización correcta de la tecnología incrementando su eficacia.
Ahora bien, cualquier proposición de valor que se realice al gestor sanitario debe generar valor. Los beneficios logrados deben superar la inversión en recursos y nunca incrementar la carga asistencial del clínico ni de la farmacia hospitalaria encargada de su gestión, por ello resulta clave que un acuerdo de riesgo compartido clínico contemple para su ejecución criterios seguidos en la práctica asistencial diaria, eludiendo incrementar costes derivados de pruebas analíticas de seguimiento no aplicadas de manera rutinaria; algunas recomendaciones podrían ser las siguientes:
-
El desarrollo clínico del medicamento debe estar inspirado en la posterior implantación de un acuerdo de pago por resultados.
-
Es muy recomendable utilizar variables que definan el éxito o fracaso de la intervención robustas, fuertemente predictivas del resultado en salud.
-
Los marcadores de respuesta y seguimiento deben ser aquellos manejados en la práctica asistencial evitando incrementar costes y carga asistencial.
-
Evitar comorbilidades que pueden interferir en la calificación de éxito o resultado sub-óptimo.
-
Involucrar a los diferentes intervinientes en el proceso desde el inicio, gestores de los servicios clínicos, gestores de farmacia hospitalaria y gestores sanitarios.
-
Definir claramente la “n” suficiente para reducir el riesgo estadístico asociado.
-
Marcar un periodo relativamente corto para definir el resultado en salud, de manera que se limite la exposición del paciente a un tratamiento potencialmente ineficaz.
-
Seguimiento periódico de la evolución del acuerdo por parte del fabricante y de los gestores clínicos y de salud para confirmar la fiabilidad del marcador y analizar en la práctica los problemas encontrados.
-
Establecer una sistemática sencilla para compensar al financiador o al gestor sanitario por el resultado (fracasos) obtenido.
-
Definir el marco legal que mejor se adapte al gestor público y al laboratorio.
-
Potenciar el uso de las tecnologías de la información como herramienta para la gestión y control de estos acuerdos.
-
Especial atención al cumplimiento estricto de la normativa en materia de protección de datos de carácter personal (Ley 15/1999).
-
Expandir y promover la utilización de registros de pacientes como elemento fundamental para el seguimiento de estos modelos de colaboración.
En resumen, un modelo de colaboración entre el gestor público de salud y el productor de nuevas tecnologías que se fundamente en una retribución a este último por los resultados en salud conseguidos, debe ser considerado siempre como experiencias limitadas, nunca con carácter general, puesto que existen diferencias en cuanto a su aplicación en entornos sanitarios diferentes. Tiene que crear valor, esto es generar un balance positivo entre el beneficio obtenido y los recursos invertidos. Finalmente, ha de ser fruto del consenso entre las partes: industria, clínico, farmacéutico y el gestor público, convencidos de la utilidad de un esquema colaborativo.















